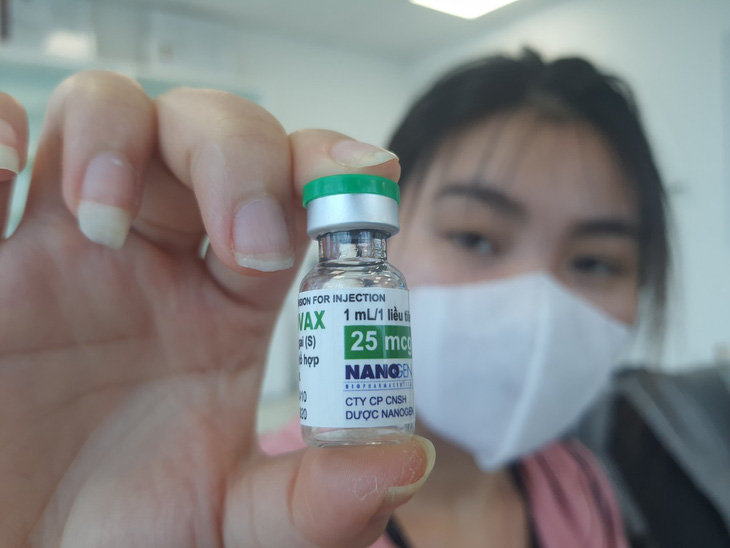
Vắc xin liều 25mcg của Nano Covax đang được chọn thử nghiệm lâm sàng ở giai đoạn 3 - Ảnh: HOÀNG LỘC
Sáng 23-6, Công ty cổ phần công nghệ sinh học dược Nanogen (gọi tắt là Nanogen) đã có những chia sẻ với báo chí sau kiến nghị cấp phép khẩn cấp cho vắc xin Nano Covax mà đại diện Bộ Y tế đánh giá là: "nóng vội, chưa đủ dữ liệu khoa học".
Tuổi Trẻ Online trích một số nội dung chia sẻ quan trọng:
Theo đại diện Nanogen, công ty được Nhà nước phân công thực hiện đề tài nghiên cứu sản xuất vắc xin Nano Covax cấp quốc gia. Đến nay quá trình thử nghiệm đang bước vào giai đoạn 3 (giai đoạn cuối cùng) với quy mô trên 13.000 người (đã có 1.000 người tiêm thử nghiệm mũi 1).
Việc gửi kiến nghị cấp phép khẩn cấp vắc xin lên Thủ tướng, theo đại diện Nanogen, là bởi biết trước Bộ Y tế không đồng ý. Công ty này còn cho rằng kiến nghị thể hiện sự mong muốn lớn nhất của đơn vị, đồng thời thay mặt cho người dân để sớm có vắc xin phòng COVID-19, an tâm quay trở lại cuộc sống.
Trong khoảng 25 phút chia sẻ với báo chí, đại diện Nanogen cho rằng đơn vị gặp nhiều khó khăn với cơ chế "xin - cho" trong quá trình nghiên cứu, thử nghiệm vắc xin Nano Covax.
"Nếu không nói, cứ âm thầm làm hoài không biết khi nào đủ vắc xin. Chúng tôi bỏ tiền ra nghiên cứu khoa học, đầu tư sản xuất, thử nghiệm một loại vắc xin mang tầm quốc tế tốn kém lắm, trong khi nói chỉ cấp phép khi thiếu vắc xin, còn đủ vắc xin không cấp phép, điều đó không hợp lý!" - đại diện Nanogen nói.
Trả lời Tuổi Trẻ Online việc Bộ Y tế cho rằng mọi phê duyệt phải dựa trên dữ liệu khoa học và kiến nghị trên là "nóng vội", đại diện Nanogen khẳng định "không nóng vội" và cho rằng: "Bộ Y tế mới nóng vội khi trả lời báo chí".
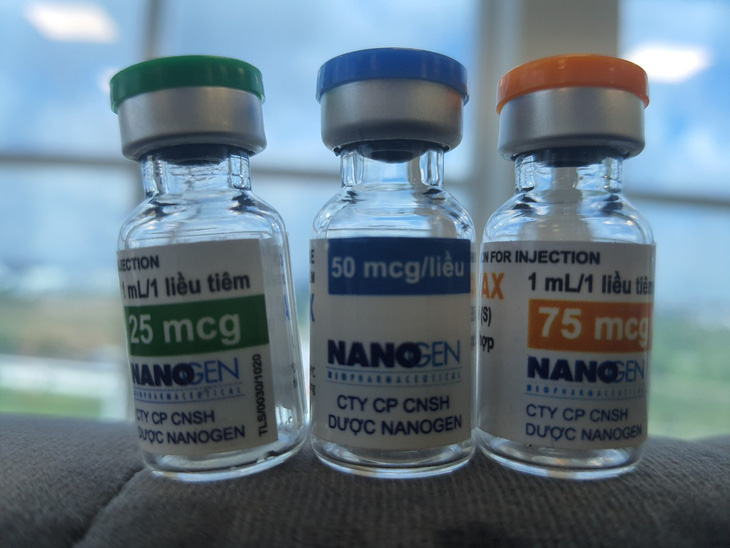
3 liều 25mcg, 50mcg, 75mcg của vắc xin Nano Covax đang được triển khai nghiên cứu, thử nghiệm lâm sàng. Bước đầu Bộ Y tế đánh giá vắc xin này có tính sinh miễn dịch tốt - Ảnh: HOÀNG LỘC
Nanogen khẳng định trong suốt quá trình thử nghiệm đều có báo cáo hằng ngày về Cục Khoa học công nghệ và đào tạo (Bộ Y tế). Các yếu tố về an toàn, sinh miễn dịch, hiệu quả bảo vệ đều thực hiện đáp ứng đúng hướng dẫn của Tổ chức Y tế thế giới (WHO).
Và kiến nghị này cũng xuất phát từ cơ sở đánh giá từ Học viện Quân y và Viện Pasteur TP.HCM, hai đơn vị độc lập được Bộ Y tế chỉ định trực tiếp thử nghiệm đánh giá.
Với câu hỏi "Nếu được cấp phép ngay, liệu vắc xin Nano Covax có đảm bảo độ an toàn cũng như hiệu lực bảo vệ khi sử dụng?".
Đại diện Nanogen trả lời: "Dĩ nhiên là an toàn. Chúng tôi không phải tự nói ra điều này, mà là Học viện Quân y và Viện Pasteur TP.HCM. Tất cả mọi khâu đều do hai đơn vị này thực hiện và báo cáo lên Bộ Y tế, chứ chúng tôi không tự viết ra là vắc xin an toàn!".
Cuối cùng, Nanogen cho biết vắc xin Nano Covax chỉ sản xuất phục vụ riêng cho người dân Việt Nam, không có nhu cầu bán ra nước ngoài. Và cho đến khi có đủ miễn dịch cộng đồng, Nanogen sẽ ngừng để tập trung sản xuất thuốc trị ung thư.
Được biết bên cạnh gửi kiến nghị cho Thủ tướng, Nanogen vừa có đơn gửi cho Bộ Y tế và bộ trưởng Bộ Y tế.
Vắc xin bắt buộc phải qua 3 giai đoạn
Theo quy định của Tổ chức Y tế thế giới (WHO) và các nước như Mỹ, châu Âu, Nhật, Hàn Quốc… vắc xin trước khi đưa vào sử dụng khẩn cấp bắt buộc phải thử nghiệm lâm sàng trên người với 3 giai đoạn, trong đó giai đoạn 3 là giai đoạn quan trọng nhất.
Việt Nam đã phê duyệt có điều kiện cho 4 loại vắc xin COVID-19 bao gồm: Pfizer, AstraZeneca, Sputnik-V và Sinopharm. Tất cả đều trải qua 3 giai đoạn thử nghiệm lâm sàng quy mô từ 20.000 đến 50.000 người tham gia.
Vắc xin Nano Covax hiện đang ở đầu giai đoạn 3, quy mô mũi 1 là 1.000 người.











Tối đa: 1500 ký tự
Hiện chưa có bình luận nào, hãy là người đầu tiên bình luận